O átomo de carbono sofre três tipos de hibridação ou hibridização. Hibridar ou hibridizar significa alterar a forma dos orbitais 2s (esférica), 2px, 2py e 2pz (halteres). Todos os orbitais citados, quando híbridos, adquirem a forma abaixo:
1º tipo: Hibridação tetraédrica ou sp3 .


A configuração espacial do carbono híbrido em sp3 é tetraédrica.
Número de orbitais híbridos = 4
Ângulo ente os orbitais híbridos = 109,28º Trata-se de carbono " saturado " (ligações sigma).
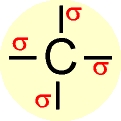
O elétron do orbital do subnível 2s ganha energia e passa a ocupar um orbital mais energético, e os elétrons dos orbitais 2px, 2py e 2pz do subnível p perdem energia e passam a ocupar, cada um, orbitais de menor energia.
Os quatro orbitais híbridos são denominados de sp3 e os elétrons passam a ter a mesma energia.
2º tipo: Hibridação trigonal plana ou sp2 .


A configuração espacial do carbono híbrido em sp2 é trigonal plana.
Número de orbitais híbridos = 3 - no plano trigonal.
Número de orbitais "p puro" = 1 - perpendicular ao plano trigonal.
Ãngulo ente os orbitais híbridos = 120º Trata-se de carbono " insaturado " com uma dupla ligação e duas ligações simples.
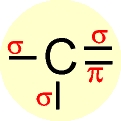
O elétron do orbital do subnível 2s ganha energia e passa a ocupar um orbital mais energético, e os elétrons dos orbitais 2py e 2pz do subnível p perdem energia e passam a ocupar, cada um, orbitais de menor energia (comparar o quadro da esquerda com o quadro da direita).
Os três orbitais híbridos são denominados de sp2 e os elétrons passam a ter a mesma energia. O elétron que permaneceu no orbital 2px é chamado de " p puro " e possui energia superior a dos orbitais híbridos.
3º tipo: Hibridação linear plana ou sp.


A configuração espacial do carbono híbrido em sp2 é linear plana.
Número de orbitais híbridos = 2 - no plano linear.
Número de orbitais "p puro" = 2 - perpendiculares ao plano linear e perpendiculares entre si.
Ãngulo ente os orbitais híbridos = 180º Trata-se de carbono " insaturado " com duas duplas ligações ou com uma tripla e uma simples ligações.


O elétron do orbital do subnível 2s ganha energia e passa a ocupar um orbital mais energético, e o elétron do orbital 2pz do subnível p perde energia e passa a ocupar um orbital de menor energia.
Os dois orbitais híbridos são denominados de sp e os elétrons passam a ter a mesma energia. Os elétrons que permanecem nos orbitaisl 2px e 2py são chamados de " p puro " e possuem energia superior a dos orbitais híbridos.
Fonte: www.algosobre.com.br

Nenhum comentário:
Postar um comentário